Doe mee aan onderzoek naar Alzheimer
Ik doe meeHoe zit het nu met het nieuwe Alzheimermedicijn?
Toch een nieuw medicijn voor Alzheimer?
In april 2019 kwam de teleurstelling: het meest hoopvolle onderzoek naar een nieuw medicijn voor Alzheimer werd stilgelegd. Een paar maanden later verscheen tot ieders verrassing het nieuws dat er toch positieve effecten waren gevonden.
Wat gebeurde er in 2019? Waar staan we nu in 2020? En welke tocht legt een medicijn af, voordat je dokter het mag voorschrijven?
Doe ook mee aan onderzoek
Meld u net als 42.738 aan
- Meedoen is geheel vrijblijvend
- Blijf op de hoogte van onderzoeken
- Beslis per onderzoek zelf of u mee wilt doen

In gesprek met Niels Prins
We stellen deze vragen aan Niels Prins: neuroloog bij het Alzheimercentrum Amsterdam en directeur van het Brain Research Center. In zijn centrum werd het nieuwe middel Aducanumab getest.
Dit artikel is onderdeel van de het interview met Niels Prins, dat te beluisteren is in deze podcast.
Vanuit een slangetje naar de hersenen
“Het wordt toegediend via een infuus; een slangetje in de ader”. Niels wijst naar zijn arm en maakt daarna een vloeiende beweging naar zijn hoofd. “Het medicijn gaat dan naar de hersenen en helpt daar het afweersysteem om de afwijkende Alzheimereiwitten op te ruimen.
Hij heeft het over het middel Aducanumab. Dat spreek je uit als Aa-duu-kaa-nuu-map.
Een groots opgezet onderzoek naar dit middel heeft in 2019 aangetoond dat het ervoor zorgt dat mensen met de ziekte van Alzheimer minder hard achteruit gaan qua denkvermogen en dagelijks functioneren.
Dit kan het eerste medicijn zijn in de cocktail voor Alzheimer
Het eerste ingrediënt voor de cocktail tegen Alzheimer
“Hoewel de effecten bescheiden zijn, lijkt het middel een positief effect te hebben op het dagelijks functioneren en het denkvermogen. De cijfers laten zien dat er ruim 20% minder achteruitgang plaats vindt in het denkvermogen en 40% minder achteruitgang op het dagelijks functioneren. Dat is best de moeite waard.” – aldus Prins.
Het denkvermogen is bijvoorbeeld het geheugen, taal, plannen, organiseren. Algemeen dagelijks functioneren zijn hele praktische zaken zoals een boterham smeren, een telefoon gebruiken, koken, afrekenen in een winkel, wassen, douchen, aankleden etcetera.
Niels vervolgt: “Ik denk dat het niet één medicijn zal zijn die de ziekte op den duur helemaal zal kunnen stoppen. Ik denk dat het een cocktail zal zijn van verschillende medicijnen. Het zou kunnen dat dit het eerste medicijn is van die cocktail.”
De turbulente tocht van het nieuwe medicijn
Wereldwijd lopen er honderden studies naar nieuwe medicijnen tegen dementie. Die worden stuk voor stuk grondig getest. Vaak wordt daardoor in een vroeg stadium al gesignaleerd dat een middel niet goed genoeg werkt. Dan stopt het onderzoek. Het is een ware afvalrace. Maar sommige middelen doorstaan de vele testen. Dan ontstaat er hoop!
Eén van die middelen is Aducanumab. Het is één van de medicijnen die al meerdere hordes heeft overwonnen. Begin 2019 kwam helaas het nieuws dat het middel onvoldoende werkt. Een verdrietig en teleurstellend bericht voor patiënten, artsen en wetenschappers die zo hard op zoek zijn naar nieuwe behandelmethodes en hun hoop hadden gevestigd op dit middel.
Later dat jaar verraste de farmaceut Biogen de wereld opnieuw, door te vertellen dat er mogelijk toch een positief effect is. Nu, in 2020, wordt alle data opnieuw geanalyseerd en wachten we op de uitslag van de Amerikaanse medicijnen autoriteit.
Aducanumab leek te falen bij de laatste check
Prins: “De effectiviteit van het medicijn Aducanumab werd getest in een wereldwijde zogeheten ‘fase 3’ studie. Meerdere onderzoekscentra, verspreid over de wereld, hielpen met het testen van het medicijn, voordat het ‘de markt op mag’.”
Voordat artsen medicijnen mogen voorschrijven, doorlopen ze drie fases waarbij het middel getest wordt in mensen. Dat noemen we klinische tests: testen in de kliniek. Soms gebruiken mensen daarvoor de Engelse term ‘clinincal trials’. Aducanumab was al in de laatste fase, fase 3, beland. Daar ging het mis.

Een dubbele check in fase 3
Om een dubbelcheck te doen, vindt zo’n fase 3 studie ook nog eens twee keer plaats. Zowel de Amerikaanse als de Europese medicijnautoriteiten (FDA en EMA) eisen dat er twee positieve fase 3 studies moeten zijn, voordat een medicijn mag worden uitgebracht.
Prins: “De resultaten die ik hier noem zijn aangetoond in één van die twee grote, parallelle studies. Een andere studie was op precies dezelfde manier ontworpen qua opzet, maar daarbij was dat resultaat niet zichtbaar. Dat heeft tot veel hoofdbreken geleid.”
Qua opbouw zijn de twee fase 3 studies dus aan elkaar gelijk. Omdat ze hetzelfde middel op dezelfde manier testen, zou er dezelfde conclusie uit moeten komen. Pas als beide studies goede resultaten opleveren, mag een medicijn op de markt verschijnen.
Omdat een fase 3 studie wel meerdere jaren kan duren en we zo min mogelijk tijd willen verliezen, voert een farmaceut die twee fase 3 studies tegelijkertijd uit. Gedurende die periode hebben de betrokken onderzoekers geen contact met elkaar. De studies worden onafhankelijk van elkaar uitgevoerd. De farmaceut houdt alle binnenstromende data wel goed in de gaten.
Dat gebeurde ook voor het middel Aducanumab. Het Nederlandse Brain Research Center (BRC) is een van de onderzoekscentra die hierbij hielp. Vanuit het BRC deden 34 mensen met een diagnose Alzheimer mee aan de studie. Wereldwijd deden er duizenden mensen mee aan deze twee fase 3 studies naar Aducanumab.

Andere uitkomsten in eenzelfde onderzoek
Prins: “Gedurende het verloop van de twee studies zag de farmaceut in de ene studie een positief effect: mensen met de ziekte van Alzheimer gingen minder snel achteruit, vergeleken met mensen die de placebo kregen – het nepmedicijn. In de andere studie was er geen verschil te zien tussen het effect van het medicijn en de placebo.” Dat is normaal gesproken een moment om de studie stop te zetten en het medicijn af te keuren. Het onderzoek is toen gestopt. Dat was in april 2019.
“Toen de onderzoekers van de farmaceut dieper in de data doken, bleken de verschillen waarschijnlijk te verklaren, doordat in de studie met het positieve effect meer mensen langer en met de hogere dosis zijn behandeld. Een lange behandeling met een hoge dosis zou dus mogelijk effectief zijn.” Dat nieuws bracht Biogen eind 2019 naar buiten.
Deze verschillen kunnen ontstaan doordat bijvoorbeeld de ene testlocatie sneller geschikte deelnemers vindt dan de andere locatie. Daardoor komt een testlocatie bijvoorbeeld sneller toe aan het langdurig toedienen van het medicijn. Of ze hebben meer deelnemers, waardoor ze meer data kunnen verzamelen over de effecten van verschillende dosissen.
Nu is de FDA aan zet
Nu buigt de FDA, de Amerikaanse medicijnen autoriteit, zich over alle beschikbare data. Zij gaan beslissen of het middel alsnog op de markt mag met een voorlopige goedkeuring of dat er eerst een nieuwe fase 3 studie moet plaatsvinden. Zo’n nieuwe studie neemt weer een paar jaar in beslag.
Prins: “Stel dat de FDA het goedkeurt, heeft dat mega veel impact, want dan is er voor het eerst iets op de markt dat de ziekte van Alzheimer afremt. De huidige beschikbare middelen zijn symptoombestrijders. Dit middel zou dus echt iets nieuws zijn. Eventueel kunnen we die combineren met de medicijnen die we al inzetten.”
Welke bijwerkingen willen we accepteren?
Niels vervolgt: “Redenen om het middel niet uit te brengen zijn de bijwerkingen van het medicijn. Bij dit type medicijn kunnen namelijk ARIA’s ontstaan: amyloid related imaging abnomalities, afwijkingen van het eiwit amyloid, die zichtbaar zijn op scans.
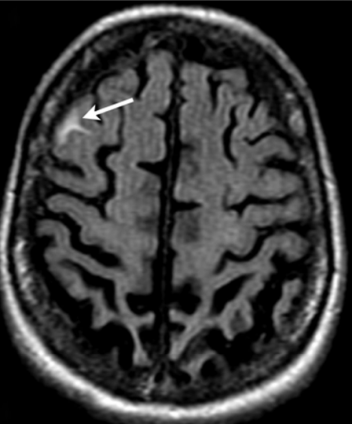
Dit middel grijpt aan op de Alzheimer eiwit in de hersenen; amyloid. Daarbij ruimt Aducanumab ook eiwit op dat in de bloedvaten zit. Daardoor worden de bloedvaten een beetje poreus bij sommige mensen. Dat veroorzaakt lekkage: er loopt een klein beetje vocht en soms ook bloed weg uit de bloedvaten.
Dat soort lekkages kun je terugzien op MRI scans. (Zie hier rechts de witte vlek bij de pijl B, red.) Daarom worden er ook herhaaldelijk MRI’s gemaakt tijdens het onderzoek, om te checken of mensen die het middel gebruiken die bijwerking hebben. Het is één van de zaken waar de onderzoekers op letten bij het testen van de veiligheid en de werking van het middel.
Het interessante is dat het merendeel van de mensen met deze ARIA’s hebben, het helemaal niet merkt. Bij de mensen waarbij ARIA’s zichtbaar waren op de scans, had 80% nergens last van. Ze ervaren geen van de nare symptomen die ARIA’s kunnen veroorzaken: verwardheid, desoriëntatie en hoofdpijn.
Als mensen wel last hebben van die bijwerkingen, is dat een reden om tijdelijk te stoppen met het medicijn. In de studie gebeurde dat ook. Mensen die last hadden van de symptomen stopten met de medicatie, totdat de ARIA’s niet meer zichtbaar waren op de scans. Daarna startten ze weer met de medicatie.”
Bij kankerbehandeling is het al vrij normaal om bijwerkingen te accepteren
De lessen van kankerbehandeling voor Alzheimerbehandeling
“Je zou de mensen die geen last hebben van de symptomen van ARIA’s het medicijn eventueel kunnen blijven geven. Ook daarover moet nog beslist worden. Bij kankerbehandelingen is het al vrij normaal om bepaalde bijwerkingen te accepteren. Daarbij wordt een behandeling tijdelijk gestopt als de symptomen van bijwerkingen starten. Je kunt de behandeling dan met hetzelfde middel of een ander middel weer opstarten als de bijwerkingen wegebben.
We zijn binnen de oncologie ook gewend om te behandelen tot de kanker weg is en opnieuw te starten met behandeling, zodra de kanker terug komt. Als we zichtbare bijwerkingen als ARIA’s op scans accepteren zo lang mensen er geen last van hebben, kunnen we die werkwijze gebruiken bij de behandeling van Alzheimer. Zo kunnen we bijvoorbeeld behandelen totdat je ziet dat het Alzheimer-eiwit is afgenomen in de hersenen. Zodra het weer zichtbaar wordt op de scans, kun je de behandeling weer opstarten.
We weten in ieder geval dat als we niks doen, dat de patiënt achteruit gaat en uiteindelijk overlijdt aan de ziekte van Alzheimer.”

Niels' mening: zou hij nu Aducanumab voorschrijven?
“Dat is een hypothetische gewetensvraag. Omdat ik nog niet alle informatie heb, in tegenstelling tot de FDA, vind ik het lastig om te kunnen bepalen of ik vind dat het middel nu al beschikbaar zou moeten worden. Zij hebben het volledige onderzoeksdossier: alle proefdierinformatie en alle informatie van de klinische testen bij mensen.
Op dit moment vind ik het nog een probleem dat we een positieve studie hebben en een studie hebben waar het positieve effect van het medicijn niet is aangetoond. Hoewel ik de verklaring van de hogere dosis snap, zou ik willen dat er een nieuwe studie komt waarbij mensen langdurig met de hoge dosis behandeld worden.
De vraag is of we daarbij ook een placebotest moeten doen of dat we alle patiënten het middel moeten geven en we in kaart brengen hoe het die mensen in de loop van de tijd vergaat. Een extra placebotest kost namelijk extra veel tijd.”

Opnieuw deelnemen met de hoogste dosis
“Alle mensen die eerder deelnamen aan de studie die is stilgelegd, hebben de kans gekregen om mee te doen aan vervolgonderzoek, waarbij iedereen het middel in de hoogste dosering langdurig krijgt. Als die data positief blijkt – dus dat de mensen geen ernstige bijwerkingen krijgen, dat het middel ook lang gebruik veilig is en dat deze mensen relatief stabiel blijven – zou dat voor mij voldoende zijn. Nu is er nog te veel twijfel.”
Met de kennis van nu
“Er moet nu nagedacht worden met de producent van het medicijn, met overheden en ziekenhuizen: op basis van de beschikbare informatie, wat is een zorgvuldige manier om met het middel om te gaan, zodat patiënten hier baat bij hebben?
Je zou dan kunnen denken ‘Laten we het geven aan mensen in schrijnende situaties: bijvoorbeeld mensen die de ziekte op relatief jonge leeftijd krijgen en snelle achteruitgang ervaren, maar verder gezond zijn’. Daar zijn we nog niet, maar ik kan me voorstellen dat dat een richting is die we op kunnen gaan.
Het middel zal ook niet goedkoop zijn. Daarom is het belangrijk dat je zorgvuldig om gaat met de euro’s die je hebt en weet wat je van het middel mag verwachten.”
Lees ook: Kun je nu zelf het nieuwe medicijn voor Alzheimer testen?
Zonder voldoende deelnemers kunnen we geen goed onderzoek doen
Niels benadrukt het belang van vrijwilligers om deel te nemen aan onderzoek. Nu loopt veel onderzoek vertraging op, omdat onderzoekers niet snel genoeg de juiste deelnemers kunnen vinden.
Meer weten? Beluister hier hele gesprek met Niels Prins in deze podcast. Meehelpen? Schrijf je in.
Alleen met voldoende deelnemers vinden we oplossingen voor Alzheimer
Heeft u de diagnose Alzheimer en wilt u bijdragen aan oplossingen? Schrijf u dan in.
Kent u iemand met deze ziekte? Deel dit artikel en attendeer hen op de mogelijkheid om deel te nemen aan onderzoek.
We respecteren uw privacy. De informatie die u met ons deelt, wordt vertrouwelijk behandeld zoals beschreven in ons privacy statement.